RöKo 2023 – Update MS: Diagnose und Therapie

Die unterschiedlichen Krankheitsverläufe der Multiplen Sklerose (MS) erfordern eine individuell maßgeschneiderte Therapie. Die MRT eignet sich als zentraler Marker für die Einschätzung des Krankheitsverlaufs.
-
Präsentationstag:18.05.2023 0 Kommentare
-
Autor:kf/ktg
-
Sprecher:Veit Rothammer, Universitätsklinikum Erlangen
-
Quelle:RöKo 2023
MS-Inzidenz steigt – auch durch Umweltfaktoren
Mit einer Prävalenz von 250-300 Erkrankten pro 100.000 Einwohnern ist die Multiple Sklerose (MS) die häufigste Autoimmunkrankheit des zentralen Nervensystems (ZNS). Auch ihre Inzidenz steigt – um immerhin 10-15% in den letzten sieben Jahren, so Veit Rothammer, Universitätsklinikum Erlangen. Bestimmte genetische Risikofaktoren gelten als gesichert: allen voran HLA-DRB1*1501 homozygot (6,7-fach erhöhtes Risiko im Vergleich zur nicht betroffenen Population), gefolgt von IL2Ra und IL-7R (jeweils 1,2-fache Risikoerhöhung).
Darüber hinaus legt eine italienische Studie aus dem Jahr 2022 nahe, dass Umweltfaktoren wie Luftverschmutzung die Entstehung der MS beeinflussen (Puthenparampil 2022). Auch für eine Epstein-Barr Virus-Infektion als Immuntrigger gibt es deutliche Hinweise (Bjornevik 2022).
MS-Diagnostik – McDonald Kriterien von 2017 gelten
Grundsätzlich kann die MS überall im ZNS Läsionen verursachen. Die erste klinische Manifestation ist häufig die Optikusneuritis, d.h. Sehstörungen führen die Patient:innen initial in die Neurologie. Läsionen des Rückenmarks sind zu Beginn selten, nehmen im Verlauf der Erkrankung aber zu. Immerhin 50 Prozent aller Erkrankten weisen 15 Jahre nach Erkrankungsbeginn eine Gangstörung auf.
Diagnostisch gelten immer noch die McDonald Kriterien in ihrer dritten Revision von 2017 (Thompson 2017), die der Kontrastmittel (KM)-gestützten MRT einen hohen Stellenwert einräumen. Um eine MS zu diagnostizieren, muss die Dissemination in Raum und Zeit vorliegen.
Für Dissemination im Raum muss an zwei Lokalisationsorten mindestens eine Läsion vorliegen, um die MS zu diagnostizieren. In der Version von 2017 sind intrakortikale Läsionen als neuer Lokalisationstyp hinzugekommen – zusätzlich zu juxtakortikalen, periventrikulären, infratentoriellen und spinalen Läsionen.
Kriterien für die Dissemination in der Zeit sind:
- KM-anreichernde oder nicht KM-anreichernde Läsionen (der Kriterienkatalog unterscheidet nicht mehr zwischen symptomatischen und asymptomatischen Läsionen) oder
- neue Läsionen auf der Folge-MRT
oder - oligoklonale Banden (OKB) im Liquor. Liegt beim klinisch isolierten Syndrom (KIS) in der MRT eine Dissemination im Raum vor, kann der Liquor die Dissemination in der Zeit ersetzen.
Klassische Verlaufsformen – MS von Anfang an progedient
Die Neurologie teilt die MS nach wie vor in die vier klassischen Verlaufsformen ein:
- Klinisch isoliertes Syndrom (KIS) – ADEM
- Schubförmig remittierende MS (RR-MS): Sie betrifft 70-80 % aller Patient:innen.
- Sekundär progrediente MS (SP-MS): 50 % aller RR-Patient:innen kommen im Verlauf der Erkrankung in diese Phase.
- Primär progressive MS (PP-MS): 15 % aller Patient:innen werden mit PP-MS diagnostiziert.
„Diese Einteilung ist allerdings eher didaktisch“, so Rothammer. Denn tatsächlich bilden sich bereits früh im Krankheitsverlauf irreversible Läsionen. Dies spricht grundsätzlich dafür, auch früh mit einer Therapie zu beginnen. Derzeit sind rund 20 Medikamente in Deutschland zugelassen, die Schübe und Progression einer MS verhindern sollen – von antineoplastischen und immunmodulierenden Wirkstoffen bis zu monoklonalen Antikörpern.
Allerdings führt die möglichst frühe Therapie auch zu Zielkonflikten. Zum einen soll ein Progress vermieden werden (NEDA = no evidence of disease action), gleichzeitig soll das Monitoring möglichst einfach sein; andererseits entstehen Therapierisiken, die Medikamente haben zum Teil starke Nebenwirkungen und die Patient:innenzufriedenheit leidet. Dies wiederum beeinträchtigt die Adhärenz und damit den möglichen Behandlungserfolg.
Verlaufsmodifizierende Therapie – ein Kompromiss
Prinzipiell gibt es derzeit zwei „Behandlungsphilosophien“ in der immunprophylaktischen Therapie (IT): 1. Den Start mit einer moderat wirksamen IT und Reaktion auf break through disease und 2. die Idee des „hit hard and early“.
Therapieziel ist zu verhindern, dass Patient:innen in die Progredienz übergehen. Bei der verlaufsmodifizierenden Therapie wird die Behandlung bei steigender klinischer Aktivität eskaliert. „Das heißt, wir hangeln uns hoch“, kommentierte Rothammer. Die Therapie sieht derzeit folgende Medikamente vor:
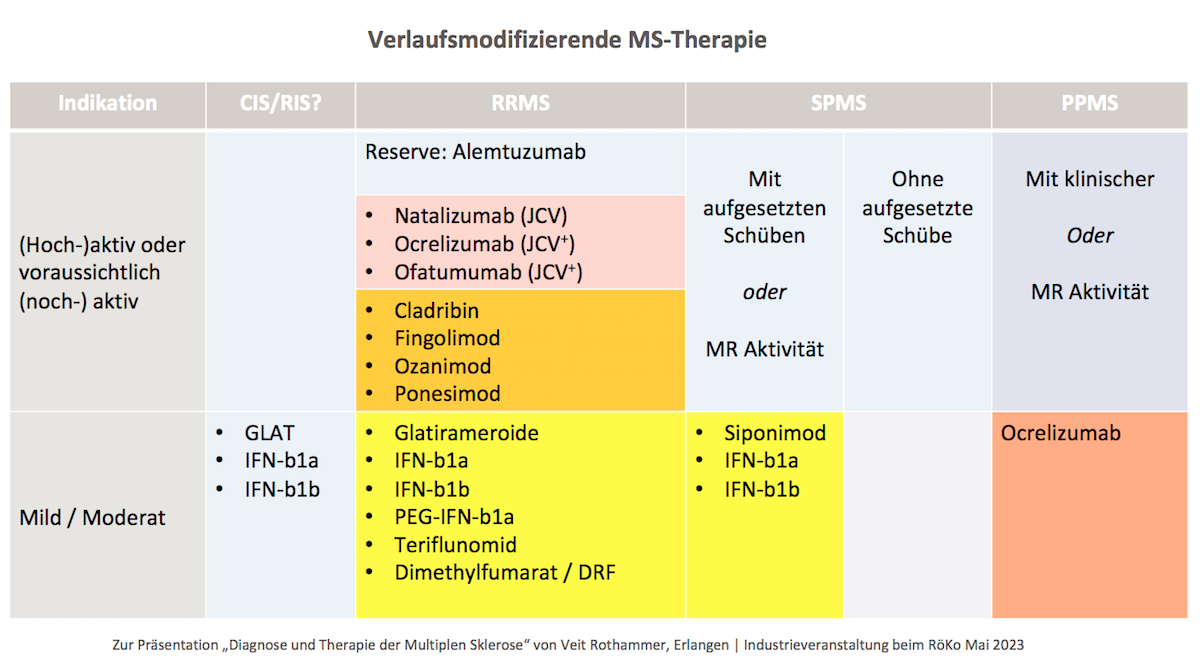
JCV+ steht für JCV-Antikörper-seropositive Personen. JCV ist die Abkürzung für John Cunningham Virus. Das Virus zählt zu den Humanen Polyomaviren 2. „JC“ sind die Initialen von John Cunningham, dem Patienten, bei dem das Virus 1971 erstmals isoliert wurde. Er gilt als opportunistischer Erreger der Progressiven Multifokalen Leukencephalopathie.
Ein Vorschlag für das dazugehörige Therapieschema in Deutschland findet sich in der im März 2023 publizierten Leitlinie der Deutschen Gesellschaft für Neurologie DGN (Hemmer 2023).
Wann sollte man nun behandeln?
Bei Patient:innen mit RR-MS erhöht ein verspäteter Behandlungsbeginn das Risiko für die Konversion zur SP-MS (Brown 2019). Gleichzeitig kommt es in der Mehrzahl der Patient:innen unabhängig von den Schüben zu einer Verschlechterung des Krankheitsbildes (Kappos 2018). Diese Aspekte führen zu der Empfehlung, Patient:innen mit aktiver MS frühzeitig zu behandeln. Bisherige Therapiestrategien könnten also unzureichend sein (Harding 2019).
Dennoch bleiben Schwierigkeiten bei der Therapiewahl bestehen: Die MS ist eine Erkrankung mit sehr unterschiedlichen Verläufen. Dies erfordert für die einzelnen Patient:innen eine maßgeschneiderte Therapieauswahl. So liegt bei circa 20% der Patient:innen eine „benigne MS“ vor – dann liegt die Expanded Disability Status Scale nach ≥ 10 Jahren bei maximal 2.
Zudem ist die Häufigkeit der sekundären Progredienz weiterhin unklar. Weiterhin haben sich die Diagnosekriterien der MS über die Jahre verändert und die Diagnose geschieht früher. Ob all dies automatisch zu einer früheren Therapieeinleitung führen sollte, ist noch unklar. Die Daten zeigen zumindest, dass eine hohe Schubaktivität im frühen Krankheitsstadium eine ungünstige Prognose bedingt (Scalfari 2010). Insgesamt ist aber die Frage zu stellen, wie sich Patient:innen sinnvoll stratifizieren und überwachen lassen, so Rothammer.
Rolle von MRT & Co
Die MRT bleibt ein zentraler Marker für die Einschätzung des Krankheitsverlaufs der MS: von der Diagnosestellung über das Therapiemonitoring und die Detektion von Nebenwirkungen bis zum Nachweis der Krankheitsprogression, so Rothammer.
Zusätzlich dienen die Serumfilament-Leichtketten (sNfL) als Laborwert für das Ausmaß der Schädigung des zentralen Nervensystems und die optische Kohärenztomographie zur Beurteilung der Nervenfaser-Schicht der Retina als Risikomarker für weitere Krankheitsaktivität.
Rothammer berichtete außerdem von einer App, mit der Patient:innen selbst über das regelmäßige Zeichnen verschiedener geometrischer Formen auf ihrem Smartphone eine Verlaufsbeurteilung der MS ermöglichen. Die App wird derzeit validiert (Graves 2023).
Radiologisch-isoliertes Syndrom
In der Diskussion kam die Frage nach dem Umgang mit dem radiologisch-isolierten Syndrom auf – also nach Patient:innen ohne klinische Symptomatik, bei denen MS-verdächtige Läsionen als Zufallsbefund festgestellt werden.
Rothammer erläuterte sein Vorgehen: Die Patient:innen werden nach einem halben Jahr zur Verlaufskontrolle einbestellt. Besteht dann der Verdacht auf einen Progress, wird eine Lumbalpunktion zu Abklärung eines autoimmunen Prozesses durchgeführt. Erhärtet sich der Verdacht, wird eine Immuntherapie angestrebt – in diesem Fall ist sie allerdings Off-Label.
Referenzen "RöKo 2023 – Update MS: Diagnose und Therapie"
Bjornevik K et al. Longitudinal analysis reveals high prevalence of Epstein-Barr virus associated with multiple sclerosis. Science 2022;375(6578):296-301
Brown JWL et al. Association of Initial Disease-Modifying Therapy With Later Conversion to Secondary Progressive Multiple Sclerosis. JAMA 2019;321(2):175-87
Graves JS et al. Preliminary validity of the Draw a Shape Test for upper extremity assessment in multiple sclerosis. Ann Clin Transl Neurol 2023;10(2):166-80
Harding K et al. Clinical Outcomes of Escalation vs Early Intensive Disease-Modifying Therapy in Patients With Multiple Sclerosis. JAMA Neurol 2019;76(5):536-41
Hemmer B. et al., Diagnose und Therapie der Multiplen Sklerose, Neuromyelitis-optica-Spektrum-Erkrankungen und MOG-IgG-assoziierten Erkrankungen, S2k-Leitlinie, 2023, in: Deutsche Gesellschaft für Neurologie (Hrsg.), Leitlinien für Diagnostik und Therapie in der Neurologie.
Online: www.dgn.org/leitlinien (abgerufen am 18.05.2023)
Kappos L et al. Greater sensitivity to multiple sclerosis disability worsening and progression events using a roving versus a fixed reference value in a prospective cohort study. Mult Scler 2018;24:963-73
Puthenparampil J et al. Multiple sclerosis epidemiological trends in Italy highlight the environmental risk factors. J Neurol 2022;269(4):1817-24
Scalfari A et al. The natural history of multiple sclerosis: a geographically based study 10: relapses and long-term disability. Brain 2010;133(Pt 7):1914-29
Thompson AJ et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurology 2017;17(2):162-73