RöKo Digital 2023 – KI-unterstütztes Lungenkrebs-Screening ab 2025

Das CT-Screening zur Früherkennung von Lungenkrebs in Deutschland wird kommen – vermutlich im Jahr 2025. Wahrscheinlich wird das Screening auf KI-Unterstützung zurückgreifen.
-
Präsentationstag:08.04.2023 1 Kommentare
-
Autor:kf/ktg
-
Sprecher:Jens Vogel-Claussen, Medizinische Hochschule Hannover
-
Quelle:RöKo Digital 2023
Lungenkrebs ist ein häufig auftretender Tumor – jährlich wird in Deutschland bei zirka 50.000 Menschen Lungenkrebs neu diagnostiziert. Die Niedrig-Dosis-CT ist erwiesenermaßen das einzige bildgebende Verfahren, dass im Lungenkrebs-Screening einen Shift hin zur Tumorerkennung in früheren Stadien erreicht (The National Lung Screening Trial Research Team 2011). Damit führt das Screening mit der Niedrig-Dosis-CT zu einer Verbesserung der Überlebensrate.
„Es ist nicht mehr die Frage, ob ein nationales Programm für die Lungenkrebs-Früherkennung kommt, sondern wann und wie. Spätestens 2025 wird die Einführung kommen“, sagte Jens Vogel-Claussen, Medizinische Hochschule Hannover (MHH), auf dem Digitalen RöKo 2023.
Die „Big 3“ der Lungenkarzinom-Früherkennung
Beim Screening sind vor allem drei Entitäten von Belang, die zukünftig zu einer Reduktion der Gesamtmortalität führen können:
- Detektion und Charakterisierung von Lungenknötchen
- Auftreten von Verkalkungen in den Koronararterien
- Diagnose des Lungenemphysems und dessen Schweregrads
Koronarkalk und Emphysem treten in der angereicherten Screening-Hochrisikopopulation in mehr als 50% der Fälle auf. Wie mit diesen beiden Zusatzinformationen umgegangen werden soll, ist noch nicht klar. Anders bei den Lungenknötchen: Ergebnisse zu deren Einordnung stammen aus dem derzeit an der MHH als einem von drei Studienstandorten in Norddeutschland laufenden Pilotprojekt zur Lungenkarzinomfrüherkennung.
Bestimmung der Knötchengröße anhand des Volumens
Wie in der HANSE-Studie beschrieben (Vogel-Claussen 2022), wird die Knötchengröße im Screening nicht per mittlerem Durchmesser, sondern per Volumen bestimmt. Durch die Volumenverdopplungsrate, die die KI automatisch berechnet, lässt sich das Wachstum der Knötchen besser bestimmen als mit dem mittleren Durchmesser. Mit der Volumetrie steigt die Spezifität des Verfahrens, während die Falsch-Positiv-Rate sinkt. „Nur ein bis zwei Prozent der detektierten Knötchen sind maligne und nur die wollen wir idealerweise biopsieren“, so Vogel-Claussen. Ziel ist ein positiver Vorhersagewert (PPV) von über 50%.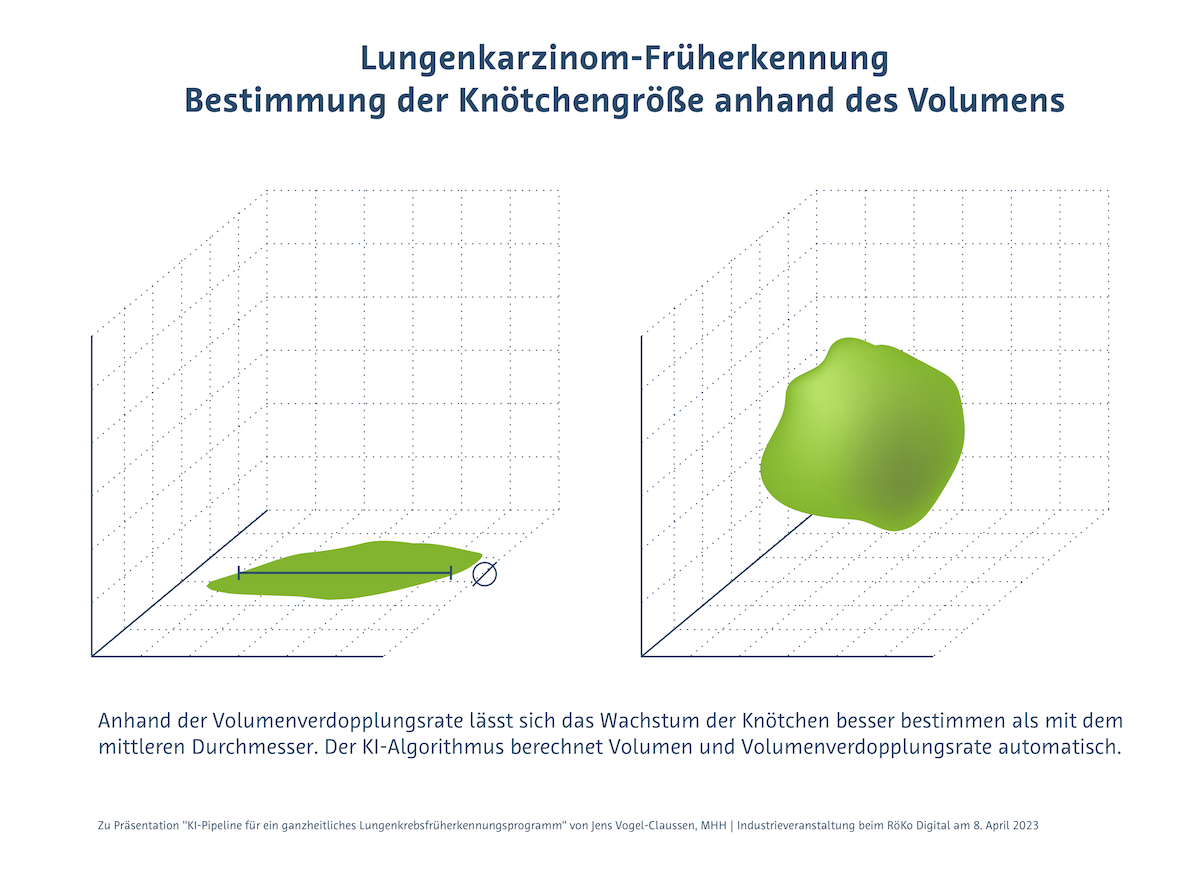
Vorläuferstudien wie die NELSON-Studie (2016) lagen mit ihrer PPV bei unter 50%, im Screening war also weniger als die Hälfte als maligne eingestufter Knötchen wirklich maligne. In einem vergleichbaren Bereich, dem Mammographie-Screening, ist die Trefferquote deutlich höher. Dies sollte auch Ziel den Lungenkrebs-Screenings sein, sagte so Vogel-Claussen. Präliminäre Daten der MHH zeigen, dass das dort durchgeführte Screening einen PPV von über 50% erreicht.
Modifizierter Lung-RADS 1.1
Zur Kategorisierung der Läsionen nutzen Vogel-Claussen und Kolleg:innen eine Modifikation von Lung-RADS 1.1 (Lung Imaging Reporting and Data System) aus dem Jahr 2022. Die Modifikation ist nötig, weil in den USA immer noch der Läsionsdurchmesser zur Größenbestimmung genutzt wird. Die stattdessen in Hannover genutzte Volumetrie stellt aber das Wachstum der Läsionen genauer dar. Radiolog:innen müssen die Volumina weder berechnen noch kategorisieren – dies übernimmt die KI. Im Bild markiert werden nur Knötchen mit positivem Befund. Das System erstellt zudem einen kurzen, strukturierten Befund. Er enthält neben Tumorgröße und -volumen weitere Daten wie das Histogramm (er gibt Auskunft über Verkalkungen in der Läsion oder langsam zunehmende Läsionsdichte, die für Malignität sprechen kann) und den multivariablen Brock-Score, der die Malignitäts-Wahrscheinlichkeit für eine Läsion angibt.
In Hannover ist die Angabe des Brock-Score verpflichtend, weil er eine gute Entscheidungshilfe dafür bietet, ob ein:e Patient:in in der Tumorkonferenz vorgestellt werden soll oder nicht.
Zielstellung für das Screening ist, die Befundung strukturiert und deutschlandweit einheitlich zu gestalten, um Vergleichbarkeit herzustellen.
Die Art der KI macht den Unterschied
Es sind viele KI-Systeme auf dem Markt, so Vogel-Claussen, aber kaum jemand betrachtet, wie gut deren Performance ausfällt. Deshalb haben er und sein Team die HANSE-KI mit anderen KI-Systemen und der Performance von Radiolog:innen verglichen. Der Direktvergleich der beiden KI-System ergab eine Übereinstimmung der Klassifizierung in 62% der Fälle. Nicht-Übereinstimmungen von als Lung-RADS >3 kategorisierten Tumoren lagen vor allem an der unterschiedlichen Volumenberechnung der KI-Systeme. Die Auflösung der CT erreicht nicht immer trennscharfe Tumorränder und die KI-Systeme ordnen diese „Graubereiche“ in der Segmentierung unterschiedlich zu.
„Ich bin deshalb ein Verfechter einer europäischen Ausschreibung für eine Software, die man flächendeckend nutzt und die Vergleichbarkeit ermöglicht“, so Vogel-Claussen. Letztlich werden aber Radiolog:innen weiterhin diejenigen sein, die final entscheiden, wie ein Tumor zu klassifizieren ist.
Google-AI und MIT-AI
Inzwischen sind auch AI-Modelle auf dem Markt, die die Malignitäts-Wahrscheinlichkeiten eines Lungenknötchens ohne menschliches Zutun ebenso genau wie oder sogar besser vorhersagen als Radiolog:innen.
Ein Team aus Forschenden des Massachusetts Institute of Technology (MIT), der Harvard Medical School und der Chang Gung Universität Taiwan hat das Deep-Learning-Modell "Sybil" so trainiert, dass es basierend auf einem CT-Scan einschätzt, mit welcher Wahrscheinlichkeit aus bestimmten Risikoregionen in der Lunge ein bis sechs Jahre nach dem Screening Karzinome werden (Mikhael 2023). Vogel-Claussen bezeichnet die MIT-Studie als „bahnbrechend“. Im Gegensatz zu einer bereits 2019 von Google veröffentlichten Studie, die aus Lungen-CTs und deren Voraufnahmen die prozentuale Wahrscheinlichkeit für die Malignität von Lungenherden zum Teil sogar genauer als Radiolog:innen errechnete (Ardila 2019), legt die MIT-Studie den Code auf GitHub offen.
Allerdings: Die Vorhersagen der KI sind nie zu 100% korrekt. Die Entscheidung, wie mit der Information umgegangen wird und was aus ihr für Patient:innen folgt, ist daher immer noch bei den Radiolog:innen anzusiedeln.
Auch der Umgang mit Zusatzinformationen aus dem CT-Screening der Lunge – zum Beispiel zu Komorbiditäten oder dem mortalitätsrelevanten Lungenemphysem – ist bis dato nicht geklärt. Zudem fehlt die prospektive Validierung der KI-Systeme. Bisher sind alle Studien retrospektiv.
Fazit
Die KI-unterstützte Niedrig-Dosis-CT-Befundung wird Teil des nationalen Lungenkrebs-Screening-Programms in Deutschland werden. Sie wird bei der Detektion, Charakterisierung und Kategorisierung der Tumoren unterstützen.
Der Umgang mit Zusatzinformationen wie Emphysemscore (oder Kalziumscore) ist noch nicht klar – hier ist mehr Evidenz nötig. Der Einsatz von KI im Screening ohne Beteiligung menschlicher Befunder:innen ist in Zukunft denkbar, hier fehlt allerdings die prospektive Validierung bisher komplett.
In der nachfolgenden Diskussion kam die Frage auf, ob sich KI auch zur Kontrolle bestehender Lungenkarzinome eignet. Vogel-Claussen nutzt für das Screening die Niedrig-Dosis-CT ohne Kontrastmittel (KM), in der Tumornachsorge kommt aber meist KM zum Einsatz. Es gibt jedoch KI-Anbieter, deren Modell mit KM-gestützten Untersuchungen arbeiten kann.Referenzen "RöKo Digital 2023 – KI-unterstütztes Lungenkrebs-Screening ab 2025"
Ardila D et al. End-to-end lung cancer screening with three-dimensional deep learning on low-dose chest computed tomography. Nature Medicine 2019;25:954–61
https://doi.org/10.1038/s41591-019-0447-x
Mikhael PG et al. Sybil: A Validated Deep Learning Model to Predict Future Lung Cancer Risk From a Single Low-Dose Chest Computed Tomography. J Clin Oncol 2023: JCO2201345
https://doi.org/10.1200/JCO.22.01345
The National Lung Screening Trial Research Team. Reduced Lung-Cancer Mortality with Low-Dose Computed Tomographic Screening, N Engl J Med 2011; 365:395-409
https://doi.org/10.1056/NEJMoa1102873
Vogel-Claussen J et al. Design and Rationale of the HANSE Study: A Holistic German Lung Cancer Screening Trial Using Low-Dose Computed Tomography. RoFo 2022;194(12):1333-45.
https://doi.org/10.1055/a-1853-8291
Walter JE et al. Occurrence and lung cancer probability of new solid nodules at incidence screening with low-dose CT: analysis of data from the randomised, controlled NELSON trial. Lancet Oncol 2016 Jul;17(7):907-16
https://doi.org/10.1016/S1470-2045(16)30069-9