RöKo Digital – KI in der Onkologie
Algorithmen unterstützen zunehmend auch in der Onkologie menschliche BefunderInnen. Die automatisierte Verknüpfung von Bildgebungsbefunden etwa mit Labordaten wäre ein erster Schritt hin zu einem ‚Digitalen Tumorboard’.
-
Präsentationstag:19.09.2020 0 Kommentare
-
Autor:mh/ktg
-
Sprecher:Heinz-Peter Schlemmer, DKFZ Heidelberg
-
Quelle:Röntgenkongress Digital 2020
Die Prozesse in der Onkologie werden immer komplexer und datenintensiver. Die Anzahl der Bilder wächst, ihre Bedeutung für die Therapieentscheidung steigt, so Heinz-Peter Schlemmer vom Deutschen Krebsforschungszentrum Heidelberg.
Das Tumorboard als zentrale Instanz bringt Informationen aus ganz unterschiedlichen Quellen zusammen und entscheidet personalisiert – auch wenn viele der einzelnen Teilergebnisse sehr standardisiert zustande kommen. „Das zusammenzutragen, kann ein Mensch gar nicht alleine leisten, dafür braucht es ein Konsortium “, betonte Schlemmer.
Was maschinelles Lernen und Künstliche Intelligenz in der Onkologie leisten können, diskutierte er am Beispiel der multiparametrischen MRT der Prostata:
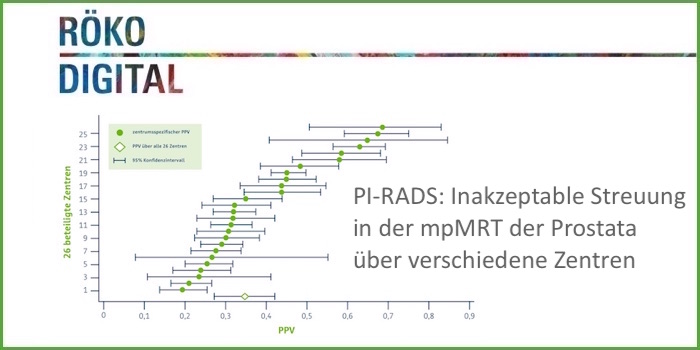
Inakzeptable Streuung in der mpMRT der Prostata
Die multiparametrische MRT der Prostata umfasst T2-gewichtete, diffusionsgewichtete und dynamische kontrastverstärkte Sequenzen. So ermöglicht sie die Darstellung der Morphologie und Aussagen über Zelldichte und Durchblutung. Das Problem: Die Genauigkeit der Prostata-MRT hängt stark von den jeweils untersuchenden Zentren ab.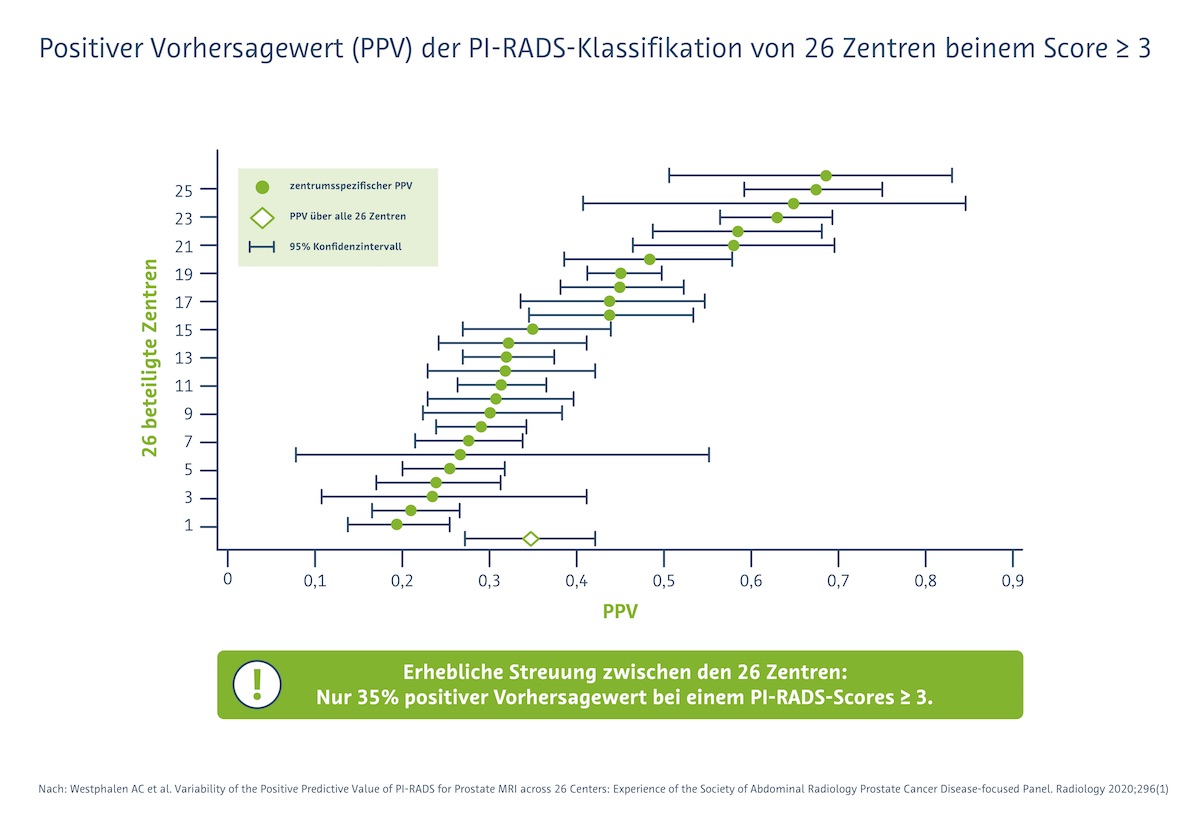
So analysierten Westphalen et al. (Radiology 2020) das PI-RADS-Scoring von 26 Zentren. Der positive Vorhersagewert eines PI-RADS-Scores ≥3 betrug lediglich 35%, und 49% bei einem PI-RADS-Score ≥ 4. Zwischen den Zentren gab es eine erhebliche Streuung. „Das ist völlig inakzeptabel“, sagte Schlemmer.
Computerunterstützung für Befundung unverzichtbar
Um die Fülle der unterschiedlichen Informationen systematisch zusammenzutragen und auszuwerten, sei Computerunterstützung unverzichtbar. „Das ist selbst über immer weitergehende Spezialisierung der Radiologen nicht mehr aufzufangen“, so Schlemmer. Zudem enthalten die Daten aus der multiparametrischen MRT weitere Daten, die dem Auge gar nicht zugänglich sind: „Das Potenzial ist hier noch längst nicht ausgeschöpft.“
ADC als solider quantitativer Parameter
Dass Algorithmen in der PI-RADS-Befundung bereits „extrem gut“ seien, hätten Bonekamp et al. (Radiology 2018) gezeigt. Sie verglichen die Tumor-Charakterisierung eines Machine-Learning-basierten Radiomics-Ansatzes mit der von RadiologInnen. Ergebnis: „In der diffusionsgewichteten Bildgebung haben wir mit dem ADC einen quantitativen Parameter, dessen Performance nur geringfügig schwächer ist als die des Radiologen“, sagte Schlemmer.
Einen vollautomatischen Deep-Learning-Algorithmus zur Detektion, Lokalisierung und Segmentierung klinisch signifikanter Prostatakarzinome testeten Schelb P et al. (Radiology 2020) erfolgreich an 259 Patienten. Grundlage waren Messungen aus der bi-parametrischen MRT mit diffusionsgewichteten und dynamischen kontrastverstärkten Sequenzen. Als Referenzstandard standen Daten aus der US/MRT-Fusionsbiopsie (MRT + Ultraschall) zur Verfügung. Ergebnis: Sensitivität und Spezifität des Algorithmus’ unterschieden sich nicht signifikant von denen der herkömmlichen PI-RADS-Klassifizierung.
Erste Metaanalysen
Zur Leistungsfähigkeit von KI-Anwendungen in der Onkologie gibt es bereits erste Metaanalysen. So analysierten Cuocolo R et al. (Radiology 2020) ein Dutzend Studien zur Diagnostik klinisch signifikanter Prostatakarzinome mit Machine-Learning-basierten Ansätzen. „Erster Gesamteindruck ist“, so Schlemmer, „die Variationsbreite ist noch breit – aber nicht breiter als über die 26 Zentren, deren Leistung Bonekamp et al. verglichen hatten. Hier ist ein enormes Potenzial für die KI enthalten.“
Digitales Tumorboard
Wie die Integration ganz unterschiedlicher Informationen auch automatisiert gelingen kann, beschrieb Schlemmer anhand eines Algorithmus’ zur Klassifizierung von PI-RADS-3-Läsionen – also den unklaren Fällen: Der Algorithmus verarbeitet Bildgebungsbefunde unter Hinzunahme der PSA-Daten. „Das ist relativ simpel machbar, und der Algorithmus wird damit deutlich besser“, so Schlemmer. Im Ergebnis könnte durch solche digitale Verknüpfung unterschiedlicher Informationsquellen so etwas wie ein „digitales Tumorboard“ entstehen.
Auf dem Weg dahin müsse noch eine Menge an Standardisierung und Validierung stattfinden, „aber die KI-Anwendungen werden kommen. Und wenn ein Algorithmus erst einmal existiert, steht er potenziell auf der ganzen Welt zur Verfügung.“
Ausblick: Versorgung in der Fläche
Großes Potenzial onkologischer KI-Anwendungen sieht Schlemmer für die ländlichen Gebiete: „In abgelegenen Regionen den Zugang zu einem hochwertigen MRT-Scanner zu ermöglichen ist leicht, aber dort auch einen entsprechenden Experten hinzubekommen ist nur schwer möglich.“
Chat und Diskussion zu „KI in der Onkologie“
KI eher Chance oder Gefahr für RadiologInnen?
Schlemmer verwies auf die Piloten früherer Jahrzehnte: „Hatten die Angst vor dem Autopiloten? Vielleicht ja, aber trotzdem gibt es heute viel mehr Piloten als damals – weil das Fliegen viel mehr Menschen zugänglich geworden ist.“ So dürfte sich auch die Bildgebung entwickeln, erwartete Schlemmer. Bei steigenden Untersuchungszahlen müsse der Radiologe, die Radiologin präsent sein und eine zentrale Entscheidung treffen. „Der Bedarf an Radiologen wird wachsen“, so Schlemmer.
Viele unterschiedliche Algorithmen oder eine Komplettsoftware?
Lässt sich eine Vielzahl unterschiedlicher KI-Anwendungen in den Alltag integrieren? Allein die unterschiedlichen Augenmerke bei der Befundung einer Thorax-Abdomen-CT sind so komplex, dass sie so bald nicht in einer einzigen Software zu finden sein dürften. Möglicherweise wird das so ähnlich wie mit den Apps auf dem Smartphone, sagte Schlemmer, es werden viele Anbieter auf dem Markt sein, und die RadiologInnen müssten verantworten, für welche Anwendungen sie sich entscheiden.
Welches sind derzeit die besten KI-Anwendungsbereiche?
„Wir Radiologen sind historisch gesehen die Pioniere der Digitalisierung in der Medizin“, so Schlemmer. Von daher habe die Radiologie einen Vorsprung gegenüber anderen Disziplinen. Das sei wohl auch eine Erklärung dafür, dass etwa die Labormedizin in Sachen Digitalisierung nicht schon viel weiter sei. Die KI werde in allen Bereichen der Medizin kommen.
KI in der Notaufnahme zur schnellen Entscheidungsfindung – diese Anregung einer Zuhörerin griff Schlemmer sehr positiv auf: „Eine hervorragende Idee. In der Notaufnahme gibt es ganz klare Fragstellungen, da kann der Computer in kürzester Zeit Vorschläge machen.“ Solche Dinge könne man trainieren, sofern nur ausreichend gute Datensätze verfügbar seien.
Wird die onkologische Diagnostik vollständig multiparametrisch?
„Das kommt auf die Fragstellung an“, so Schlemmer. Wenn etwa die genaue Anzahl von Metastasen zu beantworten sei, sei mindestens eine multiparametrische, unter Umständen sogar eine multimodale Bildgebung nötig. Aber die Algorithmen dürften hier künftig mit Vorschlägen für die Diagnostik aufwarten.
Ausblick: Wissenstransfer und Datenschutz
Der Computer kann nicht besser werden als wir Experten und die Daten, mit denen wir ihn trainieren, resümierte Schlemmer, aber er kann das vorhandene Wissen dorthin bringen, wo es noch nicht ist. Problematisch sind derzeit noch der Datenschutz und die Datenverwertung: „Das gehört zunächst in die Politik, aber wenn das gelöst ist, dürfte es sehr schnell gehen.“Referenzen zu „KI in der Onkologie“
Bonekamp D et al.
Radiomic Machine Learning for Characterization of Prostate Lesions with MRI: Comparison to ADC Values
Radiology 2018;289(1):128-137
Cuocolo R et al.
Machine learning for the identification of clinically significant prostate cancer on MRI: a meta-analysis
Radiol 2020 (online 30. Juni)
Schelb P et al.
Simulated clinical deployment of fully automatic deep learning for clinical prostate MRI assessment
Radiol 2020, online vor print (August 2020)
Westphalen AC et al.
Variability of the Positive Predictive Value of PI-RADS for Prostate MRI across 26 Centers: Experience of the Society of Abdominal Radiology Prostate Cancer Disease-focused Panel
Radiology 2020;296(1). Online Apr 21 2020